Cenni di anatomia : retina e papilla ottica
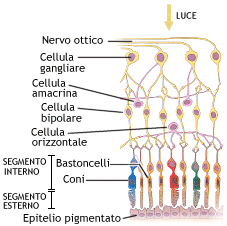
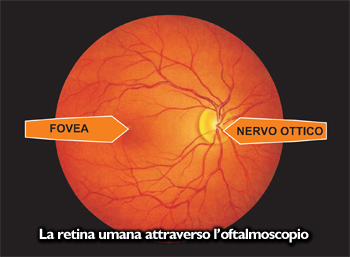
La nostra retina, spessa circa 0,5 mm, è costituita da diversi tipi di cellule nervose (vedi foto strati retinici). Un particolare tipo di queste, le cellule ganglionari, hanno un prolungamento filiforme (chiamato assone) che si continua, insieme a quello di circa 1.200.000 altre cellule gangliari, a costituire il nervo ottico il cui aspetto, osservando il fondo oculare, è quello rappresentato nella foto e viene detto ” disco o papilla ottica”. Tramite questo nervo l’informazione visiva viene portata al cervello.
L’occhio ha una “consistenza” al tatto determinata dalla presenza nel suo interno di una quantità di liquido trasparente (l’umore acqueo). Questa “consistenza” viene più propriamente definita pressione oculare (detta anche “IOP”, dall’acronimo inglese Intra Ocular Pressure) ed è determinata da una condizione di equilibrio fra la produzione e il deflusso dell’umore acqueo dall’occhio e viene misura in mmHg (millimetri di mercurio). Per comprendere come questo efficiente meccanismo possa alterarsi, delineando il quadro della malattia detta “glaucoma“, è necessario illustrare qualche cenno di anatomia.
Cenni di anatomia: le fibre nervose retiniche
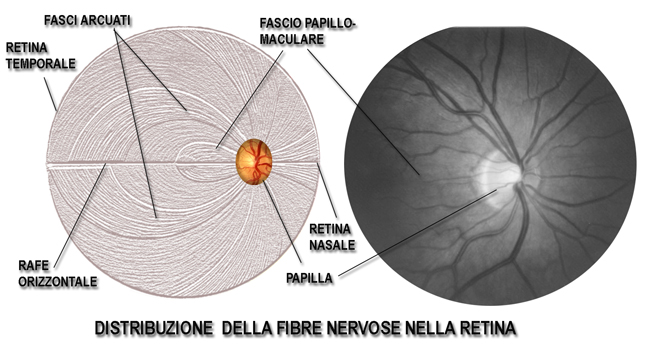
Nella foto viene ricostruito ed evidenziato il decorso delle fibre nervose retiniche. Le fibre che provengono dalla macula seguono un decorso diretto verso la papilla, formando un’area fusiforme ( fascio-papillo-maculare) che rappresenta la più importante via di comunicazione per la funzione visiva. Anche le fibre dell’area nasale seguono un decorso diretto verso la papilla, mentre le fibre che provengono dalla retina temporale devono seguire un decorso arcuato attorno al fascio papillo-maculare e non attraversano il rafe orizzontale linea che forma una netta demarcazione tra le due metà della retina, superiore ed inferiore.
I circa 1.200.000 assoni (i “fili elettrici” di connessione) delle cellule ganglionari, che costituiscono lo strato delle fibre nervose retiniche, sono distribuiti su tutto l’ambito retinico con un andamento particolare prima di raccogliersi nella papilla ottica (quindi nel nervo ottico), come mostrato in figura. Le fibre retiniche arcuate del fascio temporale (quelle lungo il decorso dei vasi) superiore ed inferiore sono normalmente le prime ad essere interessate e le più sensibili al danno glaucomatoso, mentre quelle del fascio papillo-maculare (cioè dirette dalla macula alla papilla) sono le più resistenti. E’ necessario un danno del 40% delle fibre nervose perché si manifesti l’area scotomotosa al campo visivo. Per cui l’accurata analisi e l’attenta valutazione del danno a carico di queste fibre può anticipare anche di anni un danno campimetrico che si evidenzierà poi al campo visivo.
Cenni di anatomia: l’angolo irido-corneale
L’ angolo irido-corneale è una struttura complessa situata all’angolo tra l’iride e la cornea. E’ principalmente attraverso questa via che l’umore acqueo esce dall’occhio e la sua valutazione, ampiezza, conformazione sono di importanza fondamentale per una corretto inquadramento del glaucoma (vedi sezione gonioscopia).
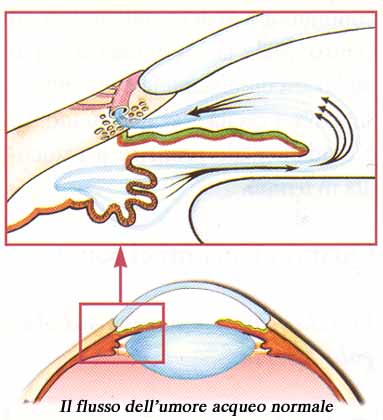
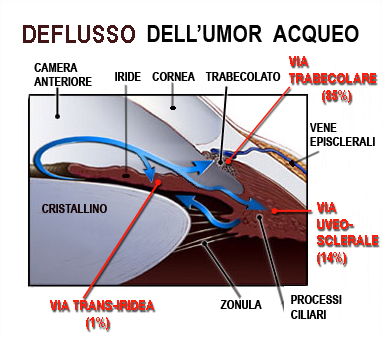
L’umor acqueo, diretto responsabile della pressione oculare (IOP) , viene prodotto dietro l’iride e precisamente dai “processi ciliari”, emanazioni digitiformi del corpo ciliare della coroide. Da questa sede, l’umore acqueo defluisce, sempre dietro l’iride (camera posteriore dell’occhio), per raggiunge la pupilla superata la quale, percorre la camera anteriore (davanti all’iride) per giungere infine presso una sorta di filtro (trabecolato) situato proprio all’angolo formato tra la radice dell’iride e la cornea (detto appunto “angolo iridocorneale” dell’occhio, vedi percorso freccia blu nella foto sotto), tramite il quale abbandona l’occhio per essere riassorbito dal sistema venoso. Grazie all’equilibrio tra la produzione e l’eliminazione dell’acqueo viene mantenuta costante la pressione oculare che nel soggetto normale varia tra i 10 mmHg (mmHg=millimetri di Mercurio) ed i 21 mmHg.
Con la freccia blu il percorso dell’umor acqueo dalla sede di produzione (processi ciliari) alla sua uscita dell’occhio (trabecolato). Possiamo immaginare l’occhio come una pallina da ping pong il cui unico punto di minor resistenza è proprio l’uscita dall’occhio del nervo ottico. Un aumento della pressione interna nell’occhio determina un danno diretto proprio al nervo ottico (danno glaucomatoso).
L’umore acqueo, secreto direttamente in camera posteriore dai processi ciliari, attraverso la pupilla raggiunge la camera anteriore dalla quale defluisce attraverso 3 vie:
- Deflusso trabecolare che costituisce la via principale del deflusso (85%). A livello del trabecolato il passaggio del liquido è meno agevole per il progressivo restringimento dei pori e poi altri ostacoli (canale di Schlemm, vene acquose, vene episclerali) possono influenzare la quantità di acqueo che esce dall’occhio.
- Deflusso uveosclerale una parte dell’acqueo devia lateralmente e fuoriesce attraversato il trabecolato uveale fino a giungere al tessuto uveale del corpo ciliare e fuoriesce dall’occhio con i vasi venosi della coroide. Rappresenta circa il 14% del deflusso dell’acqueo in condizioni normali, ma potrebbe acquistare notevole importanza nelle situazioni di alterato deflusso trabecolare.
- Deflusso irideo. Infine vi è un assorbimento diretto da parte dell’iride non bene quantificabile, ma che sicuramente è poco rilevante nella dinamica del deflusso dell’acqueo.
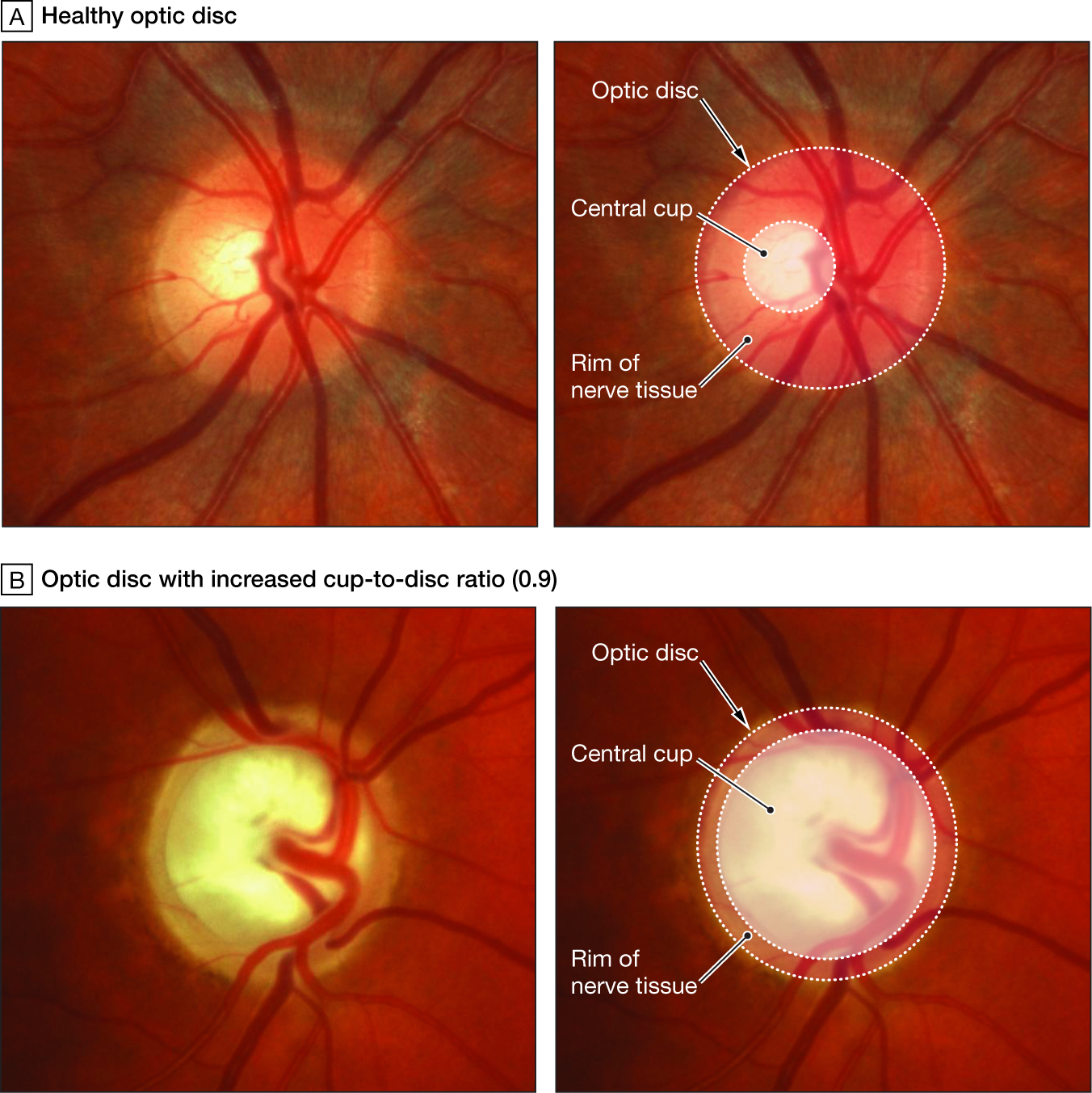
La papilla ottica nel glaucoma
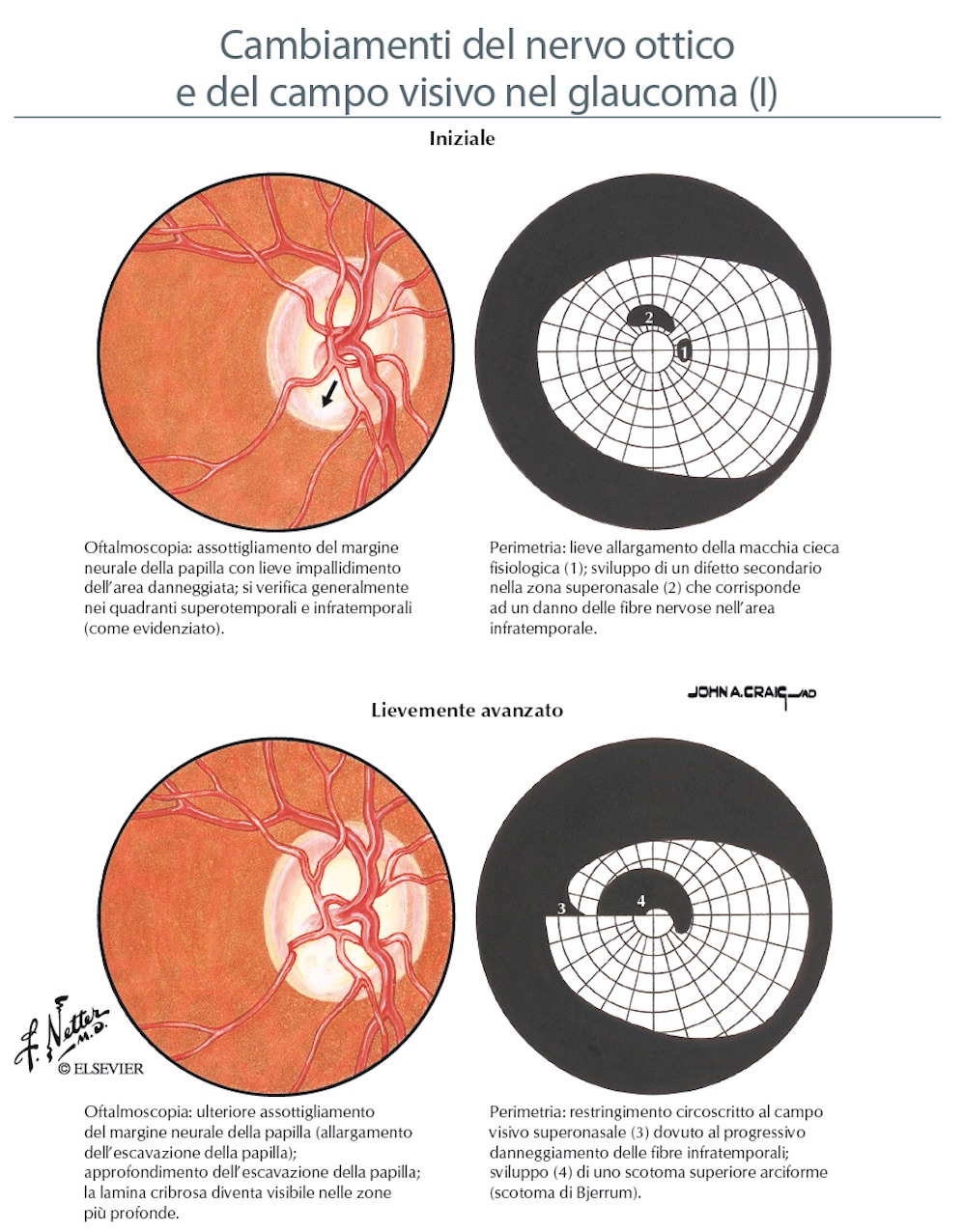
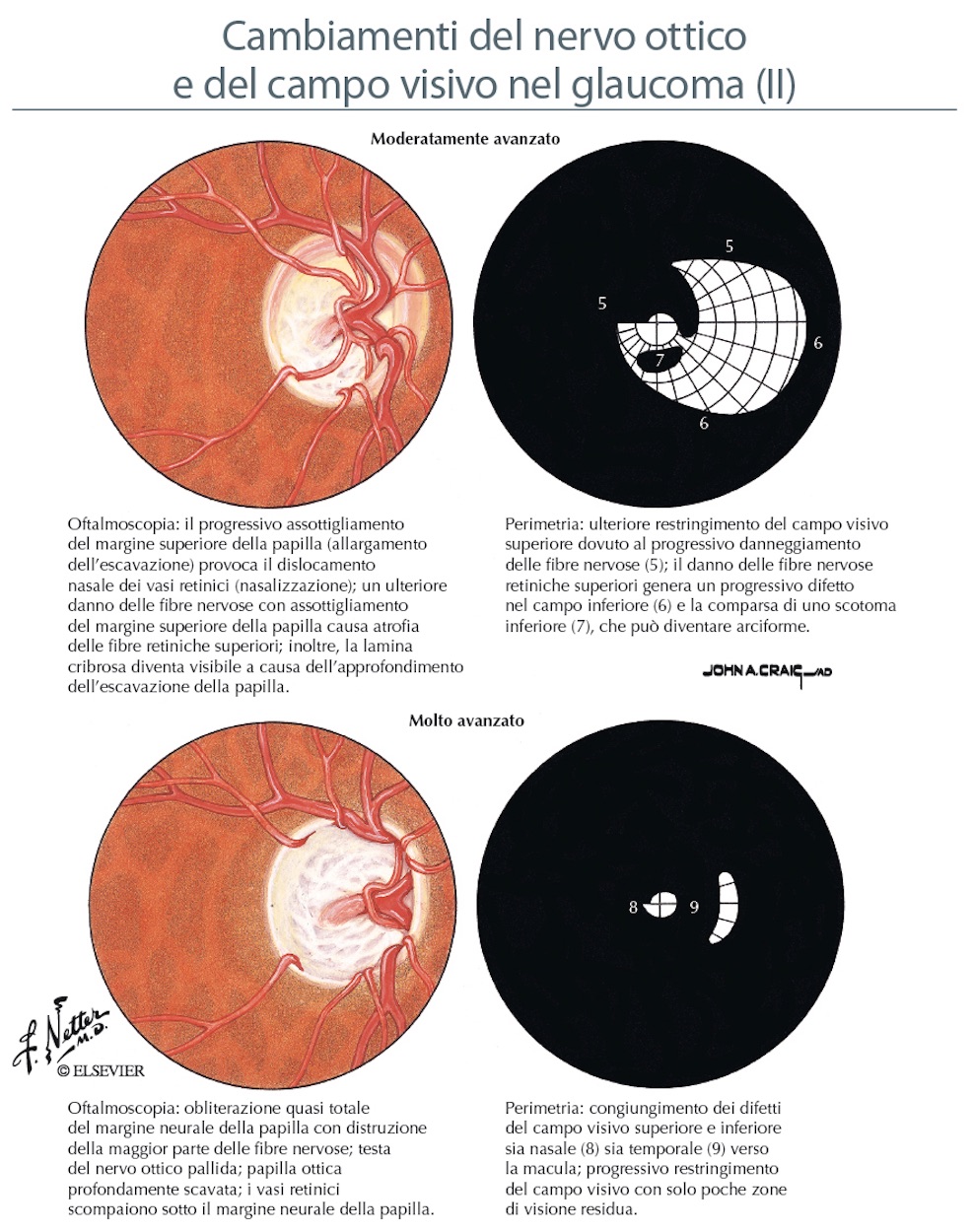
Nelle foto sono evidenti le modificazioni della papilla ottica con la progressione del danno glaucomatoso.
Così come le fibre nervose subiscono un perdita del loro numero nell’evoluzione della malattia glaucomatosa, a carico della papilla ottica si riconoscono delle modificazioni progressive che ne cambiano l’aspetto (degenerazione di Schnabel e apoptosi). Molte sono le variazioni individuali dell’anatomia papillare, ma in generale la papilla è rosea ed ovalare con un diametro circa 1,5 mm, una parte centrale senza tessuto retinico detta escavazione fisiologica, un bordo roseo (rima neurale) e dei margini netti che la separano dal restante piano retinico. Nel glaucoma si realizza un progressivo aumento dell’escavazione a scapito della riduzione della rima neurale (rapporto cup/disc = escavazione/papilla; il normale è di 0,3 nelle fasi avanzati raggiunge 0,9) sino alle fasi terminali con papilla pallida ed escavata a pentola. Ma l’ampiezza dell’escavazione è di per sè di significato limitato se non associato ad altri fattori di rischio e una grande escavazione non è necessariamente patologica.
La pressione intraoculare (Intra Ocular Pressure: IOP) e la tonometria
La pressione intra oculare (IOP dall’acronimo inglese Intra Oculare Pressure), è misurata mediante uno strumento dedicato (il tonometro ) e viene espressa in mmHg i cui valori normali, come abbiamo detto, oscillano tra i 10 e i 21 mmHg con un valore medio di circa 16 mmHg . La IOP aumenta fisiologicamente nel corso della vita con l’età e varia inoltre da individuo ad individuo e durante il giorno, normalmente in relazione al ritmo circadiano risultando essere più elevata nelle prime ore del mattino e più bassa la sera con nuovo incremento notturno. Aumenta infatti in posizione supina (quando si dorme) e vari fattori influiscono sul suo andamento: la respirazione, il battito cardiaco, il livello di pressione arteriosa. Una differenza tra i due occhi di oltre 3 mmHg è sospetta per glaucoma così come una variazione di oltre 5-6 mmHg nelle misurazioni tonometriche registrate in una giornata (curva tonometrica ). Durante la visita, l’oculista, può utilizzare diversi strumenti per la misurazione della pressione intraoculare, (tonometro ad applanazione, ad indentazione, fonometro a soffio d’aria, tono Pen, Perkins, Pascal).
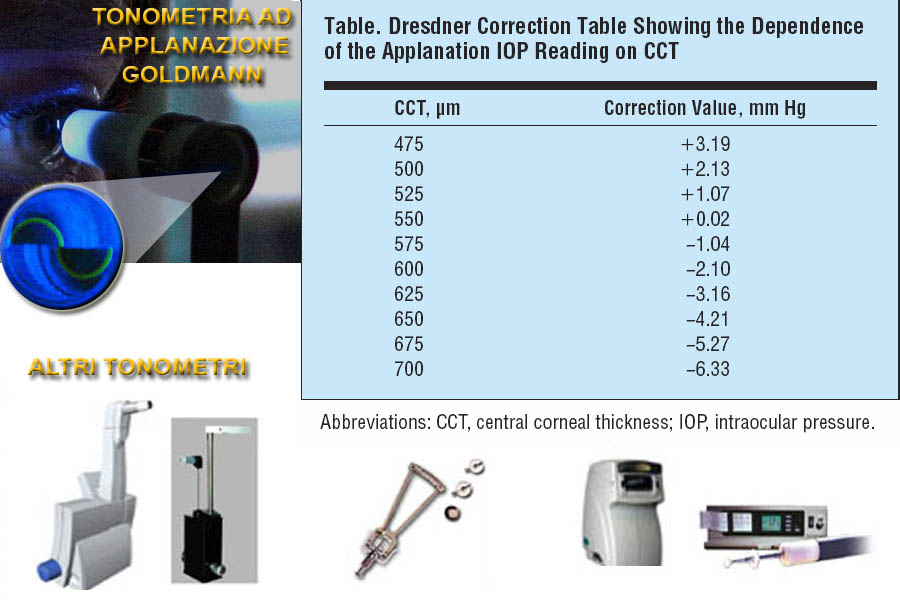
Nella tonometria ad applanazione secondo Goldmann (Gold Standard nella misurazione della IOP) si procede con anestetizzazione topica dell’ occhio con un collirio anestetico e successivamente si utilizza un colorante (fluoresceina). Viene poi accostato alla cornea un cono di plastica che presenta un prisma con due semicerchi dati dall’applanazione corneale (cerchio a sinistra). Con la manopola micrometrica del tonometro si regola la pressione esercitata da questo sulla cornea e si potrà leggere la pressione intraoculare (IOP) quando i due semicerchi saranno giustoapposti. Sotto, sono rappresentati altri tonometri, il Pascal, il Goldmann, lo Schiotz, il pneumotonometro (a soffio), No Contact Tonometer. Nella tabella a destra della foto (Dresdner correction table), tratta dalla pubblicazione Effect of Central Corneal Thickness, Corneal Curvature, and Axial Length on Applanation Tonometry di M. Kohlhaas e al. Arch Ophthalmol. 2006;124:471-476, sono riportati i valori di correzione della IOP in relazione allo spessore pachimetrico corneale centrale (CCT).
La tonometria ad applanazione di Goldmann, sicuramente la più diffusa, è molto precisa (rappresenta l’apparecchio di riferimento per la valutazione di altri tonometri e viene considerato standard). Si basa sulla legge Imbert-Fick, per cui la Pressione interna di una sfera (l’occhio) è uguale al rapporto tra la Forza esterna (data dal tonometro) e l’ Area della sfera sulla quale viene esercitata la pressione (3,06 mm quadrati per il tonometro di Goldmann). In quest’ultimo strumento il calcolo è fatto con l’ipotesi di una pachimetria di 520 µ quindi cornee con uno spessore maggiore potrebbero dare valori di lettura al Goldmann non veritieri (con valori misurati più alti della effettiva IOP) come cornee inferiori ai 520 µ potrebbero altresì dare valori più bassi della reale IOP (sottostimando quindi un potenziale glaucoma). In questi ultimi anni quindi si è sempre più accentuata l’attenzione sulla possibile relazione esistente tra la IOP e lo spessore corneale centrale (il CCT) misurato tramite la pachimetria ed oggi tale rilevazione è considerata indispensabile e complementare per una corretta valutazione della pressione oculare effettiva. Nella valutazione dello spessore corneale ci sono delle variazioni razziali e sono state proposte diverse tavole di correzione (Dresdner, Ehlers, Shah, Orssengo-Pye) che tengono conto dello spessore corneale centrale e alcune della curvatura corneale. Inoltre è particolarmente importante questo valore per una corretta valutazione della pressione oculare nei pazienti sottoposti a chirurgia refrattiva (Kohlhaas).
Il glaucoma ad angolo aperto non ha predilezione di sesso, ricorre più frequentemente e gravemente nelle popolazioni nere e la sua incidenza aumenta con l’aumentare dell’età. Fattori genetici hanno notevole incidenza con una predisposizione familiare accertata (ai genitori e fratelli di soggetti glaucomatosi è d’obbligo un accurato controllo della pressione endoculare). A partire dagli anni trenta di questo secolo sono stati condotti numerosi studi sulla frequenza del glaucoma, i cui risultati hanno indicato una prevalenza del 2% nella fascia di popolazione con età superiore a 40 anni. Il 25% delle persone normali al dì sopra dei 65 anni ha una pressione intraoculare di 20 mmHg o più’ elevata. Livelli di pressione intraoculare pari a 21 mmHg o addirittura superiori si riscontrano nel 7-10% della popolazione, mentre pazienti che hanno una pressione intraoculare al dì sotto dei 18-20mmHg hanno un minore rischio di sviluppare glaucoma e conseguenti danni al nervo ottico. Statisticamente 2 persone su 100 sono affette da glaucoma (in Italia si stima ne siano affetti circa 500.000) e molto spesso non ne sono a conoscenza, perché i sintomi di tale malattia sono quasi sempre trascurabili nelle fasi iniziali è quindi importante controllare sempre la pressione oculare in occasione di una visita oculistica.
I sintomi del Glaucoma
Il danno al campo visivo incomincia nella media periferia e spesso non è avvertito dal paziente che mantiene una buona visone centrale sino alle fasi avanzate della malattia. Da sinistra in alto: la perdita della porzione superiore del campo visivo che progressivamente peggiora coinvolgendo l’area inferiore per lasciare solo un residuo visivo (ma magari con un visus elevato 8-9/10) centrale (in basso a destra). Il glaucoma (ad angolo aperto) progredisce in modo insidioso nel corso degli anni senza sintomi significativi nè segni, sino a quando non determina un danno campimetrico (danno al campo visivo) di una certa entità tale da essere percepito dal paziente come una zona buia nel campo visivo. E’ solo allora (purtroppo!) che si reca dall’oculista, il quale non può che accertare che lo stato attuale della malattia, seguirne e curarne l’evoluzione, ma il danno sino ad allora istauratosi è irreversibile.
L’aumento della pressione oculare per un’alterazione del deflusso o della produzione dell’umore acqueo, se non curata, può causare nel tempo, un danno progressivo ed irreversibile del nervo ottico (neuropatia glaucomatosa) la cui patogenesi è ancora da chiarire, ma che si traduce comunque in un danno delle fibre nervose retiniche. Questo si manifesta clinicamente con la perdita del campo visivo che iniziando dalla sua porzione medioperiferica ha andamento centripeto verso l’area maculare.
Esempio di progressione del danno glaucomatoso (che si realizza anche in 30 anni) in caso di glaucoma ad angolo aperto a tensione (IOP) non molto elevata. A sinistra è schematicamente rappresentata la papilla ottica normale (con escavazione fisiologica) e un normale campo visivo (il punto nero al suo centro è la normale “macchia cieca” data proprio dalla papilla ottica). Al centro si evidenzia una progressione dell’escavazione con comparsa di un danno al campo visivo ( salto nasale ) che può essere ancora del tutto inavvertita dal paziente. Infine a destra lo stadio avanzato del glaucoma, con papilla escavata “a pentola” e campo visivo quasi completamente spento (residuo visivo centrale).
E’ per questa lenta e subclinica perdita progressiva del campo visivo, di cui il paziente si rende conto solo tardivamente, quando ormai il danno è avanzato e non più recuperabile e che può evolvere sino alla totale cecità nel glaucoma avanzato (papilla escavata a “pentola”, subatrofia glaucomatosa), che il glaucoma è una malattia grave ed insidiosa. Comunque, nella maggioranza dei casi, una volta posta diagnosi di glaucoma, con l’opportuna terapia ed i continui controlli, si riesce a mantenere una eccellente funzione visiva per tutta la vita. Nella forma ad angolo aperto (la più comune) infatti, è una malattia ad evoluzione lentissima (oltre 30 anni), che generalmente risponde molto bene alla terapia farmacologica ed eventualmente a quella parachirurgica (laser / SLT) e chirurgica .
La diagnosi: elementi di valutazione alla visita oculistica
L’osservazione che ad una più elevata pressione endoculare corrisponda un maggiore rischio di sviluppare danni al nervo ottico è oramai riportata da migliaia di studi scientifici. Ma la pressione oculare non è l’unica variabile che ci conduce alla diagnosi. Infatti, con i nuovi mezzi di indagine strumentali in nostro possesso si è osservato che la meta’ dei pazienti che hanno un nervo ottico visibilmente glaucomatoso e un difetto al campo visivo tipico per glaucoma, hanno una pressione intraoculare inferiore ai 22 mmHg alla prima visita. Inoltre anche con valori della pressione oculare nei limiti della norma si può avere un danno glaucomatoso (definito questo “glaucoma sine ipertensione” , o glaucoma a tensione normale, NTG) nel quale si realizza una lenta ma progressiva perdita del campo visivo.
La raccolta di un’ accurata anamnesi (considerando l’età del paziente, la sua familiarità per glaucoma o per diabete, la presenza di miopia, etc.), l’esame del segmento anteriore, la tonometria, la gonioscopia, la valutazione biomicroscopica della papilla ottica e delle sue caratteristiche (escavazione, colorazione, valutazione della rima, rapporto cup/disc, insn’t rule, eventuali asimmetrie etc.), la valutazione delle fibre nervose se visibili (a luce aneritra, distribuzione, eventuale rarefazione, difetti a nastriformi, a pettine, arcuati come quello della foto evidenziato dalle frecce blu etc.) sono gli elementi attraverso i quali l’oculista già nell’ambito della visita è in grado di selezionare il paziente con sospetto glaucoma per sottoporlo poi agli accertamenti specialistici necessari a completare il quadro clinico.
Viceversa anche l’occasionale riscontro di una pressione oculare più alta della norma che non è sufficiente a fare diagnosi di glaucoma. Un aumento della pressione oculare di poco al di sopra del range definito normale potrebbe essere infatti tranquillamente tollerato dal paziente per tutta la vita. Si parla in questi casi di ipertensione oculare. E’ ovvio comunque che tali soggetti vanno seguiti con particolare attenzione in quanto possono facilmente evolvere in glaucoma. Fattori anatomici, metabolici e fisiologici comportano un’ampia variabilità individuale di vulnerabilità del nervo ottico, ossia vi sono soggetti che possono tollerare a lungo e senza danni pressioni oculari elevate, mentre altri possono sviluppare lesioni glaucomatose anche a livelli pressori relativamente bassi. Pertanto, non possiamo escludere che vi sia un glaucoma solo sulla base dei valori di pressione intraoculare. Nel corso della visita, l’oculista, oltre alla valutazione del segmento anteriore (e gonioscopia), misurerà quindi la pressione dell’occhio mediante la tonometria e valuterà biomicrocospicamente la papilla ottica (escavazione, colorazione, valutazione della rima, rapporto cup/disc, eventuali asimmetrie etc.) e le fibre nervose (a luce aneritra, distribuzione, eventuale rarefazione, difetti a nastriformi, a pettine, arcuati etc.), esami semplici e non invasivi che completati da un’attenta anamnesi oculare (considerando l’età del paziente, la sua familiarità per glaucoma o per diabete, la presenza di miopia, etc.), gli consentirà di poter sospettare la presenza o meno di glaucoma identificando i casi sospetti che dovranno essere sottoposti ad esami più approfonditi descritti nei paragrafi seguenti.
Gonioscopia
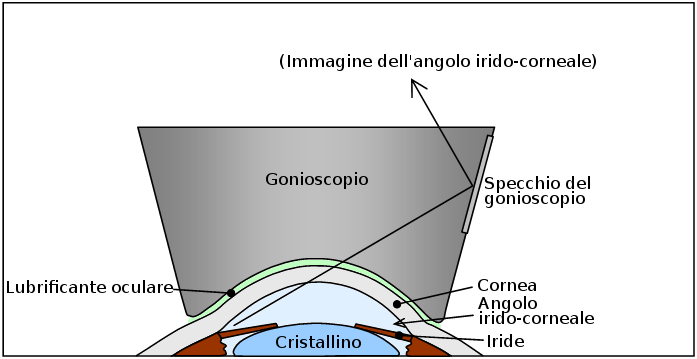
Lo studio dell’angolo irido-corneale viene detto gonioscopia . L’oculista effettua la valutazione gonioscopica appoggiando una lente provvista di uno specchio (assolutamente non fastidiosa e dopo instillazione di un collirio anestetico), che consente la visualizzazione delle strutture angolari (banda ciliare, sperone sclerale, trabecolato, la linea di Schwalbe). Vi sono diverse classificazioni e modalità di visualizzazione dell’angolo, ma quella più diffusa è sicuramente quella di Shaffer. Come abbiamo detto, questa particolare regione oculare è responsabile della fuoriuscita dell’85% dell’umore acqueodall’occhio è quindi la particolare conformazione anatomica è direttamente responsabile dell’aumento della pressione oculare e in definitiva del differente approccio terapeutico da perseguire. In effetti è proprio in base all’ampiezza e all’apertura dell’angolo che vengono distinte varie forme di glaucoma. Il più diffuso, detto glaucoma cronico ad angolo aperto, la malattia sin qui descritta, presenta alla gonioscopia un angolo aperto e ampio, mentre il glaucoma ad angolo ristretto o chiuso, molto più raro, rivela alla gonioscopia, un angolo molto ristretto o addirittura non esplorabile (chiuso). Quest’ultimo, è responsabile del glaucoma acuto, che ha un’insorgenza, una manifestazione sintomatologia ed un’evoluzione completamente differenti.
A sinistra: classificazione del grado di apertura dell’angolo secondo Shaffer. Al centro: immagine gonioscopica dell’angolo, si nota la formazione accidentale di un nevo. A sinistra: le strutture angolari. Una simpatica animazione con visione “da parte dell’oculista” delle strutture angolari è al link: http://www.academy.org.uk/tutorials/gonio.htm#
Il Campo visivo
Stanza del campo visivo in Studio Brusasco di Rivoli
Rispetto ad una mira di fissazione posta all’infinito la visione complessiva dello spazio intorno a noi che il nostro occhio riesce a percepire viene definita campo visivo e varia a seconda delle conformazione dell’orbita del naso della posizione dell’occhio rispetto a queste. Comunque generalmente si estende superiormente per 50°, nasalmente per 60°, 70° inferiormente e 90° temporalmente. Più ci si allontana dalla visione centrale e minore e la qualità visiva e la sensibilità retinica.
Il campo visivo è la porzione di spazio che un occhio immobile riesce a percepire davanti a sé. Normalmente il campo visivo si estende: 60° nasalmente, 50° superiormente, 90° temporalmente e circa 70° inferiormente. Nel campo visivo normale si può evidenziare, circa 10°- 20° temporalmente alla fissazione, un’area cieca (la cosiddetta “macchia cieca”), che corrisponde alla proiezione spaziale della papilla ottica priva di fotorecettori, “macchia” che nello svolgimento delle attività quotidiane non viene mai percepita. L’esame è di facile esecuzione, non invasivo, richiedendo solo un po’ di attenzione e collaborazione. Il paziente viene posto al davanti di una semicupola illuminata tenuemente, deve fissare davanti a se una mira e deve premere un pulsante alla comparsa di uno stimolo luminoso puntiforme di grandezza e intensità variabile. Un’alterazione del campo visivo (difetto campimetrico) è quindi una modificazione più o meno estesa e/o più o meno profonda della sensibilità retinica in quella determinata area che viene definito scotoma . Lo scotoma può essere “assoluto” , quando in una determinata area del campo visivo non viene percepito neanche lo stimolo a più alta intensità, o “relativo” quando sempre in un’area definita alcune mire luminose possono essere percepite ed altre no. Il campo visivo è un esame fondamentale per lo studio della patologia glaucomatosa e il monitoraggio dell’eventuale progressione subclinica della malattia pertanto, deve essere effettuato periodicamente (da 3 mesi ad 1 anno a seconda della valutazione dello specialista), confrontato con i precedenti e correlato con gli altri esami oculistici. L’esecuzione del campo visivo assume particolare importanza, oltre che per il glaucoma, anche per altre patologie di interesse neuro-oftalmologico (infiammazioni tossiche o metaboliche delle vie ottiche, patologie ischemiche cerebrali, neuriti, sclerosi multipla, etc.). Il campo visivo può essere studiato attraverso dei perimetri manuali (perimetria Goldmann) o computerizzati (Humphrey, Octopus, Medmont…) che misurano la risposta alla sensibilità alla luce in ciascun punto della retina, data dalla differenza percepibile fra luminanza dello sfondo e luminanza dello stimolo che viene rappresentata graficamente, mediante dei grafici e delle espressioni numeriche (o scala di grigi).
La pachimetria
La pachimetria è la misurazione dello spessore della cornea, importante valore da correlare con la pressione intra-oculare. (spessore medio centrale è di crica 550 micron= 0,55 mm).
Inoltre il pachimetro ci consente il controllo della progressione di determinate patologie corneali, lo studio valutazione di lesioni cicatriziali corneali e quello dell’evoluzione dei cheratoconi, nell’edema corneale (ispessimento dovuto alla imbibizione di acqua) come nella cornea guttata, inoltre la pachimetria è un esame indispensabile per le procedure di chirurgia incisionale e laser della cornea e per integrazione dei dati nel glaucoma. Sono oggi a disposizione diverse strumentazioni per misurare lo spessore corneale.
Lo Strato delle Fibre Nervose Retiniche (SFNR)
Per quanto lo studio delle caratteristiche della papilla ottica sia indicativo per glaucoma a volte per le ampie variabilità anatomiche di queste, l’interpretazione può non essere sufficientemente rivelatrice della malattia glaucomatosa. Lo studio dello strato delle fibre nervose retiniche (SFNR, in inglese RNFL da Retinal Nerve Fiber Layer), è invece molto sensibile per la diagnosi di glaucoma.
A sinistra le foto delle fibre nervose, rispettivamente occhio destro (sopra) e sinistro (sotto). Al centro, sempre dello stesso paziente, il campo visivo Goldmann e a destra il campo visivo computerizzato. Con le frecce rosse sono indicati i difetti delle fibre nervose, caratterizzati dell’aspetto grigio diffuso del fondo oculare, che ha perso la sfine striatura data dalle fibre e da quello “nudo” dei vasi. E’ possibile valutare anche una asimmetria dell’escavazione papillare ed un’evidente assottigliamento della rima superiore in OD in corrispondenza della perdita delle fibre. Il campo visivo correlato evidenzia un evidente difetto con scotomi assoluti e relativi arcuati inferiori (speculari rispetto al difetto delle fibre), mentre la perimetria computerizzata rivela oltre agli scotomi assoluti la grave perdita di sensibilità perilesionale (OS salto nasale).
Infatti perché un danno glaucomatoso sia rilevabile al campo visivo mediante perimetria in bianco e nero, può essere necessaria una perdita sino al 40% dello strato delle fibre nervose , rappresentando lo studio dello SFNR un esame estremamente utile e precoce per la diagnosi e l’evoluzione del glaucoma. In un soggetto normale vi è una perdita fisiologica delle fibre nervose equivalente a circa lo 0,4% annuo, mentre questa percentuale sale al 4% annuo in un soggetto con glaucoma non ben compensato. Vi sono numerose tecniche per la valutazione dello SFNR. Durante la visita, l’oculistica può, con l’osservazione biomiscroscopica del fondo oculare, utilizzare un filtro rosso-privo (verde), che gli consente di valutare lo strato delle fibre nervose retiniche evidenziando eventuali “difetti” di queste. Tali “difetti” possono essere “diffusi”, “nastriformi”, “arciformi”, “a pettine o pettinati”, “a settore” più o meno ampi e più o meno evidenti in rapporto all’anatomia del fondo oculare della papilla e del contrasto offerto dall’EPR, all’opacità dei mezzi ottici (p.e. sono mal valutabili nei miopi per l’atrofia tipica peripapillare e nei soggetti chiari con scarso EPR). Le foto con filtro delle fibre nervose retiniche sono oggi routinariamente eseguite presso i centri di riferimento glaucomi ed utilizzate per seguire e valutare la progressione del danno glaucomatoso nel tempo.
Gli esami elettrofisiologici
I PERG infatti rappresentano una risposta elettrica retinica ad uno stimolo pattern originata principalmente a livello delle cellule ganglionari ed il loro studio è in grado di evidenziare anche un danno glaucomatoso iniziale.
Gli studi elettrofisiologici della funzionalità del nervo ottico e della retina rappresentano un altro efficace strumento per il completamento della diagnosi di malattia glaucomatosa, essendo esami di facile esecuzione e non invasisi. In passato nella valutazione del danno glaucomatoso precoce, sono stati utilizzati i potenziali visivi evocati (PEV) con stimolo pattern, con risultati non specificatamente attendibili in quanto i PEV, riflettendo essenzialmente la funzione maculare, sono alterati principalmente nei disturbi del campo visivo centrale, inoltre presentano forti influenze determinate dall’età del paziente dalla trasparenza dei mezzi ottici e dalla refrazione. Metodica più recente meno influenzata da tali fattori e oggidì usata è l’elettroretinografia con stimolo pattern (PERG). Il razionale dell’utilizzazione dei PERG nello studio del glaucoma, si basa sugli studi di Maffei e Fiorentini (1981) che suggerirono l’ipotesi che questi potenziali traessero origine dalle cellule ganglionari della retina e potessero quindi rappresentare un indice molto precoce del danno di tali cellule. I PERG infatti rappresentano una risposta elettrica retinica ad uno stimolo pattern originata principalmente a livello delle cellule ganglionari ed una alterazione della loro risposta è in grado di evidenziare anche un danno glaucomatoso iniziale. Inoltre nei PERG, mentre la latenza può non essere influenzata dalle diverse condizioni patologiche (glaucoma compreso), le ampiezze sono fortemente ridotte in caso di danno specifico alle cellule ganglionari acquisendo, rispetto agli altri esami elettrofisiologici, una elettiva utilità clinica nella diagnosi precoce del glaucoma. Pur con questa specificità i PERG non sono diffusamente utilizzati perchè manca ancora una standardizzazione riconosciuta nei vari ambulatori.
OCT: Optical Coherence Tomography
L’OCT è un sistema per acquisizione ed elaborazione di immagini bidimensionali della retina. Il sistema utilizza una tecnica non a contatto e una metodica non invasiva ottenendo immagini con una risoluzione di circa 7/8 micron relative alla morfologia retinica e riuscendo ad evidenziarne le eventuali patologie. Le strutture retiniche, compresa la papilla ottica e le fibre nervose possono essere studiate con questo strumento che proietta sulla retina un fascio di luce coerente laser vicino all’infrarosso (820 nm).
Tramite una telecamera lo strumento registra ed elabora con un computer le immagini riflesse dalla retina ed una volta elaborate possono essere differenziati i vari strati retinici. Si possono studiare lo spessore delle fibre nervose retiniche mediante scansioni a diversi diametri dalla papilla e poi confrontarle con un database inserito nel computer per valutare le anormalità. E’ possibile inoltre effettuare scansioni e misurazioni della papilla ottica.Gli OCT di ultima generazione (dominio di Fourier/Spettrale) sono spesso associati ad un sistema di acquisizione SLO (Scanning Laser Ophthalmoscope) dell’immagine in real-time di riferimento. L’utilizzo contemporaneo di questi due sistemi di ultima generazione permette di eseguire esami in miosi con estrema semplicità ottenendo immagini di altissima qualità fortemente correlate alla patolgia retinica. La Struttura Complessa di Oculistica dell’Azienda Ospedaliera di Terni è dotato di tali strumenti (Optical Coherence Tomography RS-3000) . Oltre l’OCT, ci sono altri strumenti idonei allo studio delle fibre nervose, come la scanning laser polarimetry (SLP) è l’unica che utilizza la proprietà fisica delle fibre nervose (birifrangenza) oltre la reflettività, per fornire una misura dello spessore. I risultati ottenuti con SLP sono riproducibili, correlati con le proprietà fisiche dello SFNR ed in grado di differenziare gli occhi normali da quelli con glaucoma. L’SLP attualmente disponibile in commercio è il “GDx”. L’esame con tale strumento è della durata di pochi minuti, non richiede dilatazione ed è ben accettato dal paziente. Gli usi clinici di SLP includono: la screening, la quantificazione dei danni in pazienti con glaucoma, identificazione dei danni iniziali in pazienti al rischio per glaucoma, lo studio nell’ipertensione oculare, differenziazione tra escavazione fisiologica e glaucomatosa, e rilevazione dell’eventuale progressione del glaucoma nel tempo. Concepito per lo studio dello spessore retinico nell’edema maculare diabetico consente attraverso la proiezione di raggio laser verde a fessura di 20 micron, acquisita poi da una videocamera digitale ed elaborata da un algoritmo al computer, di avere una immagine topografica dello spessore retinico del polo posteriore e della regione peripapillare. La misurazione dello spessore maculare rappresenta un indiretta valutazione dello SFNR maculare in quanto lo strumento ci dà un lettura dell’intero spessore maculare. E’ possibile anche effettuare alcune misurazioni della papilla ottica e dell’escavazione. Confocal Scanning Laser Ophthalmoscopy (HRT). Questo strumento prodotto dalla Heidelberg Retina Tomograph (Heidelberg Engineering, Inc.), utilizza uno scanning laser confocale a bassa potenza che scannerizza la retina nelle 3 dimensioni (x,z,y) per ottenere un’imagine elaborata dal software del computer in 3 dimensioni della retina e del disco ottico. Una misurazione indiretta dello SFNR può essere ottenuta dall’altezza della superficie retinica al di sotto del piano di riferimento. Per approfondimenti: http://www.heidelbergengineering.com/.
Il glaucoma a pressione normale
(NTG Normal Tension Glaucoma o sine ipertensione)
ll glaucoma a pressione normale (NTG Normal Tension Glaucoma, definito anche “sine ipertensione”). Un danno di tipo glaucomatoso a carico delle fibre nervose della papilla ottica e del campo visivo può essere individuato anche in pazienti con pressione oculare nel range della normalità di 10-21 mmHg (dal 10-30% della popolazione con prima diagnosi di glaucoma).
A sinistra: trattamento laser per glaucoma. E’ un trattamento ambulatoriale di alcuni minuti indolore. Al centro: un ampio difetto arcuato inferiore delle fibre nervose in un glaucoma senza tensione (NTG). A destra la papilla normale e quella glaucomatosa a confronto.
Questa forma particolare di glaucoma presenta la stessa evoluzione della patologia glaucomatosa associata a IOP elevata e costituisce per l’oculista, un serio problema terapeutico e diagnostico rappresentando sempre una diagnosi di “esclusione”. L’ipotesi eziopatogenetica più accreditata, oltre alla possibile ereditarietà, (p.e. è altamente frequente nei giapponesi), è quella basata sulle osservazioni di AA., di una “disregolazione vascolare” che comporta una diminuzione od alterazione della perfusione della testa del nervo ottico con conseguente evoluzione del danno glaucomatoso. Secondo Flammer, uno dei maggiori sostenitori di questa ipotesi, tale disregolazione vascolare sarebbe più frequente nelle donne, nelle cardiopatie come alterazioni del ritmo cardiaco, e nella Sindrome vasospastica. Un’analisi sistematica dei pazienti glaucomatosi ha rivelato che quasi il 50% dei casi di glaucoma a tensione normale e solo una percentuale leggermente più bassa dei casi di glaucoma a tensione elevata con moderato aumento della IOP, erano affetti da sindrome vasospastica primaria. Recenti ricerche condotte da Flammer hanno dimostrato che la disregolazione vascolare aumenta la sensibilità dell’occhio ai cali e ai bruschi picchi di pressione oculare. Questo spiegherebbe perché alcune persone possono tollerare una bassa pressione arteriosa o un’alta IOP senza sviluppare danni e altre no.
Il NTG si presenta rispetto al glaucoma cronico angolo aperto:
• più frequentemente nel sesso femminile ed in associazione con alcune patologie autoimmuni.
• più frequentemente associato con affezioni da vasospasmi periferici (fenomeni di Raynaud, emicrania).
• più tardivamente (mediamente una decade)
• con più definiti difetti del campo visivo
• la papilla presenta più frequentemente incisure ed emorragie
• più alta e grande incidenza di atrofia peripapillare
Tali caratteristiche non indicano una particolare evolutività il cui decorso può essere differente nei singoli soggetti. Comunque sia perché l’insorgenza è più tardiva, sia per il decorso meno aggressivo rispetto al glaucoma cronico ad angolo aperto, i pazienti che divengono legalmente ciechi a causa di un NTG sono pochi. La terapia è rivolta anche qui a ridurre ulteriormente la pressione endoculare (la pressione target è di circa il 25% più bassa rispetto alla IOP basaline che può essere ottenuta con trattamento medico, laser, o chirurgico), a migliorare la perfusione della testa del nervo ottico (correggere il vasospasmo, dislipidemie e dismetabolismi, l’insufficienza carotidea, etc), riducendo eventuali picchi ipotensivi notturni (stile di vita, dieta arricchita di sale, cortisone).
Il glaucoma acuto ad angolo chiuso
Il glaucoma acuto si presenta improvvisamente con violento dolore all’occhio interessato che si può irradiare alla fronte. L’occhio è molto rosso e la visione è appannata. Possono associarsi nausea e vomito, ma una pronta terapia è in grado di riportare nel giro di pochi minuti la situazione alla normalità.
ll glaucoma a pressione normale (NTG Normal Tension Glaucoma, definito anche “sine ipertensione”). Un danno di tipo glaucomatoso a carico delle fibre nervose della papilla ottica e del campo visivo può essere individuato anche in pazienti con pressione oculare nel range della normalità di 10-21 mmHg (dal 10-30% della popolazione con prima diagnosi di glaucoma). ll glaucoma a pressione normale (NTG Normal Tension Glaucoma, definito anche “sine ipertensione”). Un danno di tipo glaucomatoso a carico delle fibre nervose della papilla ottica e del campo visivo può essere individuato anche in pazienti con pressione oculare nel range della normalità di 10-21 mmHg (dal 10-30% della popolazione con prima diagnosi di glaucoma).
A differenza del glaucoma primario ad angolo aperto, praticamente privo di una sintomatologia riconoscibile per anni, il glaucoma ad angolo chiuso è corredato da un insieme di segni e sintomi caratteristici: aloni intorno alle luci, spesso con grave appannamento della vista, arrossamento e forte dolore all’occhio interessato a volte si associano nausea e vomito, sintomi che portano il paziente colpito subito dall’oculista. Più frequente nell’età adulta e senile e quasi sempre ad insorgenza monolaterale, il meccanismo alla base del glaucoma acuto è l’improvvisa chiusura dell’angolo irido corneale determinato dalla particolare anatomia che si presenta negli “occhi predisposti” (sono occhi piccoli, spesso ipermetropi, con camera anteriore ridotta di profondità (bassa) ed angolo iridocorneale ristretto). Per varie cause , ma spesso di notte quando la pupilla si dilata arriciandosi verso l’angolo, questo può “chiudersi” bloccando improvvisamente il deflusso dell’umore acqueo dall’occhio. La pressione oculare si alza repentinamente raggiungendo anche i 40-50 mmHg (tono lapideo) con comparsa dei sintomi descritti. A volte il decorso non è così acuto mantenendo un andamento cronico con periodi di crisi caratterizzate da un sintomatologia modesta (dolore perioculare ed alone intorno alle luci ), la cui presenza va sempre indagata da parte dell’oculista nei soggetti con angolo ristretto, familiarità per glaucoma, ipermetropia elevata. Nel caso di chiusura acuta dell’angolo, una tempestiva terapia mirata alla sua riapertura è in grado di riportare la pressione dell’occhio ai valori normali generalmente senza gravi conseguenze per la funzione visiva. Una volta riconosciuta la possibilità anatomica di sviluppare un glaucoma acuto, si può effettuare una terapia medica con colliri che agendo sulla costrizione pupillare prevengono la chiusura dell’angolo, ma una perforazione con laser dell’iride (iridotomia YAG laser effettuabile in di pochi secondi, di pratica ambulatoriale e quasi del tutto indolore) mette al riparo da questo tipo di complicazione e spesso non costringe il paziente all’uso continuativo di colliri che determinano miosi. Entrambi gli occhi devono essere trattati perché prima o poi l’attacco di glaucoma acuto si presenterà nell’occhio controlaterale se non preventivamente curato. Con l’aumento del volume del cristallino legato all’età in questi occhi anatomicamente predisposti, può essere necessario l’intervento chirurgico.
Il glaucoma congenito
In questa rara forma di glaucoma (1 neonato su 10.000) una malformazione dell’angolo irido-corneale con alterazione più o meno grave del deflusso dell’umore acqueo è responsabile dell’aumento della pressione endoculare che determina, in un periodo in cui i tessuti oculari sono ancora in delicata via di sviluppo, un marcato aumento di dimensioni del bulbo oculare (buftalmo). Il danno al nervo ottico, seppur più lento rispetto all’adulto per l’elasticità dei tessuti oculari del bimbo, progredisce se non si interviene chirurgicamente, sino alla cecità. La cornea aumentata di dimensioni, è diventata rapidamente opaca ed il piccolo paziente si presenta molto irrequieto con spiccata fotofobia e lacrimazione. Per tale motivo ogni apparente aumento di dimensioni degli occhi o un’anomala lacrimazione deve spingere i genitori a portare il piccolo paziente dall’oculista, infatti riconosciuti in tempo e se sottoposti precocemente alla terapia chirurgica, questi occhi possono sperare in una guarigione definitiva.
I glaucomi secondari
Fanno parte di questo nutrito gruppo di glaucomi, tutte quelle forme che comportano una aumento “secondario” della pressione oculare, differenziandosi così dalla forma primitiva (glaucoma cronico ad angolo aperto), come conseguenza di altre affezioni oculari, di effetti collaterali di alcuni farmaci, di ferite o traumi oculari. Il glaucoma si può associare a un grande numero di affezioni oculari (a sinistra la anomalia di Axenfield), sistemiche e traumatiche (al centro dislocazione della IOL, a destra lussazione della lente) . Si possono associare a glaucoma l’eterocromia dell’iride(iride di differente colore), le cataratte complicate, le lussazioni del cristallino e della IOL, le iridocicliti, le trombosi venose retiniche, la retinopatia diabetica, postumi di interventi sul segmento anteriore e posteriore dell’occhio, alcuni tumori, malattie proliferative ed emorragiche, ferite e traumi che comportino la chiusura dell’angolo. L’evoluzione e la terapia di tali forme dipende dalla malattia responsabile dell’occlusione delle vie di deflusso e frequentemente la terapia medica non è sufficiente mentre quella chirurgica non sempre è risolutiva.
Glaucoma secondario da cortisone
Gli effetti principali a carico dell’occhio dell’abuso di cortisone sono la cataratta e il glaucoma. Un forma particolare che merita essere menzionata a parte è quella secondaria all’uso di cortisonici (glaucoma da cortisone) assunto sia per via sistemica per malattie su base infiammatoria ed autoimmunitaria (l’artrite reumatoide, il lupus eritematoso sistemico, la febbre reumatica, l’artrite reumatoide, le patologie di tipo allergico, ecc.), nelle papilliti e nelle neuriti retrobulbari, sia localmente nelle affezioni oculari, nella terapia di congiuntiviti, iriti, uveiti non specifiche. Infatti l’assunzione per periodi prolungati di tempo di cortisone determina (con una variabilità geneticamente determinata) la comparsa di un glaucoma (spesso associato a cataratta) che ricorda quello del Glaucoma Primario ad Angolo Aperto, ma con una evoluzione più rapida e grave. L’uso di colliri con cortisone va quindi limitato ai casi di effettiva necessità, per periodi brevi di tempo e sempre sotto controllo oculistico.
Terapia del Glaucoma
La meta’ dei pazienti che hanno un nervo ottico visibilmente glaucomatoso e un difetto al campo visivo tipico per glaucoma hanno una pressione intraoculare inferiore ai 22 mmHg alla prima visita. Pertanto, non possiamo escludere che vi sia un glaucoma solo sulla base dei valori di pressione intraoculare.
La terapia medica attuale del glaucoma si incentra nei concetti di neuroprotezione e neurorigenerazione. La pressione target od “obbiettivo pressorio”, è la pressione oculare media, specifica per ogni singolo paziente, ottenuta con un trattamento che previene un ulteriore danno glaucomatoso nell’occhio/individuo in considerazione. Nella foto alcune terapie per il glaucoma.
Sebbene è oramai ampiamente dimostrato che, più elevata è la pressione endoculare e maggiore è il rischio di sviluppare danni al nervo ottico e quindi il controllo della IOP (farmacologicamente o chirurgicamente) è e rimane l’obiettivo prioritario della terapia antiglaucomatosa, oggi si tende a stabilire altri obiettivi altrettanto importanti che sono mirati alla prevenzione della neurodegenerazione (prevenzione dell’apoptosi) e alla possibilità di neurorigenerazione.
Una volta posta la diagnosi di glaucoma non si deve comunque pensare, che tale malattia potrà portare inevitabilmente alla perdita della vista. Il glaucoma è sì una malattia seria, ma che se accuratamente seguita e trattata consente di mantenere nella maggior parte dei casi, una eccellente funzione visiva per tutta la vita. Il glaucoma cronico, generalmente bilaterale, è una malattia ad evoluzione molto lenta (oggi si tende ad attribuirle una durata non inferiore a 30 anni), di inizio subdolo e con pochi sintomi, generalmente sopra i 30-35 anni, di difficile identificazione se non valutata dall’oculista. Abbiamo visto come il danno delle cellule ganglionari si possa realizzare in seguito a numerosi e differenti fattori (gli insulti meccanici, l’insufficienza vascolare, le mutazioni genetiche, i danni tossici e metabolici, i meccanismi immuni o autoimmuni, e la degenerazione nervosa secondaria). Nella genesi e nell’evoluzione del glaucoma ogni paziente può avere in associazione e in grado più o meno elevato, ciascun dei detti fattori; quindi se l’obiettivo primario rimane il controllo della pressione endoculare, non meno importante è ridurre gli effetti dannosi dei fattori associati. Le possibilità di scongiurare l’evoluzione del glaucoma sono indubbiamente maggiori quanto più precoce è il trattamento e più puntuale l’esecuzione delle norme terapeutiche da parte del malato. Le scelte terapeutiche dipendono dall’età del soggetto e soprattutto dallo stadio evolutivo della malattia. Le nuove metodiche chirurgiche proposte in questi ultimi anni, i nuovi farmaci a nostra disposizione, l’acquisizione del concetto, nella terapia medica, di neuroprotezione e neurorigenerazione, una più sensibile individuazione nel riuscire a raggiungere e mantenere il valore della ”Pressione Target” spesso al di sotto dei 15 mmHg, o meno (ossia quella pressione endoculare, specifica per ogni singolo paziente, che ci garantisca con presumibile attendibilità, un rallentamento della malattia glaucomatosa tale da assicurare una valida qualità visiva per tutta la vita) lasciano ancora irrisolto il quesito se l’approccio terapeutico migliore sia medico o chirurgico. La terapia medica è rivolta al miglioramento delle condizioni del deflusso dell’umore acqueo o alla riduzione della sua produzione e consiste nella somministrazione quotidiana di colliri che aumento il deflusso dell’umore acqueo e/o riducono la sua produzione. Nella maggior parte dei casi, questa terapia è da sola sufficiente a ridurre la pressione oculare al di sotto dei valori di rischio. In altri casi si deve ricorrere all’aggiunta di colliri che hanno effetti sulla pupilla e a volte si ha la necessità di somministrare terapie con farmaci per bocca. In alcuni casi, si può ricorre alla terapia con laser (ALT/ SLT, /Trabeculoplastica con SOLX Laser ) che con una applicazione ambulatoriale, sono in grado di migliorare il deflusso dell’umore acqueo. Sempre in relazione al raggiungimento della pressione target è possibile poi scegliere, l’opzione chirurgica, che si avvale oggi di nuove metodiche come la viscocanalostomia, la sclerectomia profonda, l’impianto di sistemi drenanti come lo Shunt d’oro (SOLX) , la classica trabeculectomia, che consente di creare una “fistola” tra la parte interna e quella esterna dell’occhio riducendo in questa maniera definitivamente la sua pressione oculare o gli impianti drenanti di valvole (ExPRESS, Molteno, Baerveldt, Ahmed).
La terapia farmacologica
I colliri oggi a disposizione per ridurre la pressione oculare sono numerosi, maneggevoli, efficaci e con modesti effetti collaterali. Vengono usati singolarmente o in associazione consentendo un ottimo controllo della IOP e con le nuove molecole introdotte nella terapia negli ultimi anni la terapia farmacologica ha ridotto fortemente la necessità di ricorrere alla chirurgia.
Dagli anni ’70 i beta-bloccanti (Timololo, Carteololo, Betaxololo, etc), rappresentano i farmaci di prima scelta nel trattamento delle varie forme di glaucoma, in quanto efficaci e ben tollerati. Si sono poi associati dagli anni ’90 un inibitore topico dell’anidrasi carbonica (Dorzolamide) ed altri colliri ad azione adrenergica (Dipivefrina, Apraclonidina, Brimonidina) derivati delle prostaglandine (Latanoprost, Travoprost,) e delle prostamidi (Bimatoprost) farmaci che per l’indubbia azione ipotensiva e per la buona tollerabilità, possono essere considerati come farmaci di prima scelta specie quando i beta-bloccanti trovano controindicazioni di carattere generale (bradicardia, ipotensione arteriosa, broncospasmo, etc.). Questi farmaci in monosomministrazione od in associazione, riescono nella maggior parte dei casi, a portare la pressione intraoculare ai valori target per quel tipo di paziente e per il grado di evoluzione del suo glaucoma. Oggi, come vedremo nel prossimo paragrafo, si affaccia un’ulteriore possibilità parachirugica di trattamento con la SLT e la Titanio Laser Trabeculoplastica (TLT) con SOLX 790 Laser i cui risultati sono estremamente incoraggianti.
La terapia parachirurgica con laser – L’ALT
L’ALT si esegue ambulatoriamente in pochi minuti, appoggiando previa una goccia di collirio anestetico, una lente con specchi (lente di Goldmann o simili) sull’occhio come mostrato nella foto. Si eseguono degli spots laser (40-80) a livello del trabecolato. Il trattamento è indolore, efficace con una riduzione del 20-30% della IOP di partenza.
Il trattamento laser nel glaucoma si esegue quando non è possibile raggiungere un valido compenso tonometrico con la terapia medica (colliri) o in casi selezionati come terapia primaria in quei pazienti che hanno controindicazioni all’uso degli stessi. E’ un trattamento indolore, ambulatoriale, con anestesia topica (collirio anestetico) e senza complicazioni importanti, se eseguito correttamente. Nella terapia del glaucoma primario ad angolo aperto, l’impiego del laser risale al 1979 quando Wise e Witter diffusero la Argon Laser Trabeculopasty (ALT) il cui obiettivo è l’aumento del deflusso dell’umor acqueo secondario alla retrazione cicatriziale dovuta all’azione degli impatti laser sul trabecolato (il “filtro” naturale presente a livello dell’ angolo irido-corneale). L’ALT viene eseguita da molti anni nel trattamento del glaucoma ad angolo aperto anche se oggi non viene praticata così frequentemente in quanto ha una perdita di efficacia nel tempo (dopo circa 3-5 anni) e anche se si può effettuare un secondo trattamento, limita la possibilità di eseguire con efficacia un ulteriore trattamento in futuro.
La terapia parachirurgica con laser – L’Iridotomia YAG
Come detto a proposito del glaucoma acuto, si può evitare la chiusura dell’angolo praticando un “buchino” dell’iride (iridotomia ) che consenta il passaggio dell’umore acqueo dalla camera posteriore a quella anteriore, con un laser YAG.
L’iridotomia YAG laser si pratica come l’ALT. Si applica una lente sull’occhio e tramite il laser YAG si effettua un forellino sull’iride. La procedura anche in questo caso è di brevissima durata, indolore, efficace e risolutiva.
Tale metodica rappresenta tutt’oggi la terapia d’elezione in tali forme. Nella terapia del glaucoma sono stati utilizzati anche altri laser la cui diffusione e pratica è però stata limitata dai non eccezionali risultati.
La terapia parachirurgica –
SLT e TLT: nuove possibilità terapeutiche
Il dott. Mark Latina di Chicago, ha presentato una nuova tecnica chirurgica detta SLT – Selective Laser Trabeculoplasty da lui messa a punto nel 1995, che utilizza un Q switched Nd YAG doppia frequenza 532 nm laser. Tale nuova metodica per la riduzione della IOP, tecnicamente sovrapponibile alla già discussa ALT, si è subito diffusa in tutto il mondo ed è stata riconosciuta dalla US Food and Drug Administration nel marzo del 2001.
Il particolare raggio laser YAG di breve durata e di bassa energia, agisce selettivamente sulle cellule ricche di melanina lasciando inalterate le cellule e la struttura della rete trabecolare circostante, rispetto all’ALT dove gli effetti termici e coagulativi degli impatti sono responsabili dei fenomeni cicatriziali che ne limitano nel tempo l’efficacia. I risultati dei trattamenti con SLT sino ad oggi conseguiti sono molto incoraggianti e rendendo questa procedura oltre che sicura, efficace, ripetibile ed affidabile, anche particolarmente gradita al paziente, perché può renderlo libero dalla schiavitù delle “gocce”. In sintesi l’SLT potrebbe diventare il trattamento di 1° scelta nel glaucoma ad angolo aperto, anche se dobbiamo attendere i risultati degli studi multicentrici tutt’ora in corso. Ancora più recente è la Titanium Laser Trabeculoplasty (TLT) con SOLX 790 Laser (approfondimenti in inglese PDF) che emette luce vicino all’infrarosso (790 nm) e che viene utilizzato per tale metodica. Rispetto alla ALT e alla SLT presenta una più profonda penetrazione (200 µ circa) senza causare danni al trabecolato aumentando il deflusso dell’acqueo con minime complicazioni. Come la SLT è ripetibile e reduce di circa il 25% la IOP basale.
La terapia chirurgica – La Trabeculectomia
Quando sia la terapia medica che quella laser non consentono un adeguato controllo della IOP non resta che la scelta chirurgica. Attualmente la operazione più diffusa é la trabeculectomia che consiste nella creazione di un “passaggio” coperto (filtrante) tra la camera anteriore e lo spazio sottocongiutivale. Tale intervento si realizza mediante l’asportazione di una piccola lamella di tessuto sclerale (trabeculectomia) dalla parete dell’occhio costituendo un “tunnel” che dalla camera anteriore dell’occhio consente il deflusso dell’umore acqueo nello spazio sottocongiuntivale (che si rigonfia formando una “bozza filtrante ” -vedi foto) consentendo quindi un suo fisiologico riassorbimento.
La tecnica chirurgica della trabeculectomia consiste nel creare un “tunnel” che consenta all’umor acqueo di uscire dalla camera anteriore e raggiungere lo spazio sottocongiutivale dove poi sarà riassorbito, come evidenziato nella foto. A livello della congiuntiva superiore (dove viene in genere eseguita), si formerà una “bozza” filtrante che non costituisce nessun fastidio nè funzionale, nè estetico per il paziente. Le complicazioni sono rare (aumento evoluzione cataratta), ma spesso la fistola tende a chiudersi rendendo vano l’intervento (per tale motivo durante l’operazione vengono oggi usati degli antimetaboliti).
Questo intervento nelle sue varianti, é efficace nell’80% dei casi, è abbastanza semplice nell’esecuzione potendosi effettuare in anestesia topica, ma presenta frequenti complicazioni non gravi, come incistamenti della bozza o chiusura della fistola che annullano l’efficacia dell’operazione (per tale motivo oggi durante l’intervento vengono utilizzati degi antimetaboliti come il 5-fluorauracile e la mitomicina). In questo caso si può “rivisitare la bozza” o ed effettuare una nuova trabeculectomia. Complicazioni più gravi con infezione della bozza, ipotensione oculare, emorragia sono rare, mentre la formazione di cataratta sembra essere accelerato dall’intervento.
La terapia chirurgica “Impianti drenanti”
(ExPRESS, Molteno, Baerveldt, Ahmed, SOLX Gold Shunt)
Gli impianti drenanti (drainage device, shunt, valve) consentono una comunicazione tra la camera anteriore e lo spazio sottocongiutivale (o sopracoroideale) al fine di ridurre la pressione interna dell’occhio. Quando la terapia laser non ha portato a significativi miglioramenti o quando altre metodiche chirurgiche come la viscocanalostomia, e la sclerectomia profonda, non hanno avuto i risultati sperati o la trabeculectomia è fallita, o in caso di pregressi interventi oculari multipli (vitrectomia, distacco di retina, trapianto corneale) o in casi di glaucoma neovascolare o complicato o post traumatico, è ancor possibile avere degli ottimi risultati mediante l’applicazione di impianti drenanti o valvole. L’idea iniziale era quella di consentire un passaggio diretto tra la camera anteriore e lo spazio sottocongiutivale . Molteno propose la prima valvola nel 1969 oggi con la nuova generazione di impianti con valvola biologica dà ottimi risultati. Ma anche altre valvole originali come la Baerveldt , o la valvola di Ahmed o l’ ExPress Mini Shunt (della Optonol Ltd., Neve Ilan, Israele), piccolo impianto in acciaio (di 400µ di larghezza per 3 mm di lunghezza) utilizzato al posto della trebeculectomia sotto uno sportellino sclerale che consente una formazione di una bozza filtrante sino ad arrivare al recente impianto di uno shunt biocompatibile in oro della SOLX risultano essere efficaci nel controllare la pressione oculare. Il Gold Shunt della ]SOLX utilizza la naturale pressione differenziale tra la IOP ed il deflusso dell’umor acqueo per ridurre la pressione endoculare, senza formazione di bozza filtrante. Questo piccola piastrina in oro (di circa 3 x 6 mm) impiantata con una singola microincisione, presenta numerosi canali microtubulari che creano un passaggio tra la camera anteriore e lo spazio sopracoideale dell’acqueo grazie alla differenza di gradiente pressorio tra i due spazi con conseguente riduzione della IOP. L’impianto non è percepito dal paziente è non crea reazioni.
Convivere con il glaucoma
La dieta, l’attività fisica e lo stile di vita nel glaucoma: come comportarsi?
II paziente glaucomatoso può condurre una vita normale. Se il danno al campo visivo non è severo (diminuendo la capacità di guidare la macchina), la vita di relazione del paziente non differisce dal quella del soggetto sano. Come già detto, il glaucoma è una malattia cronica che si evolve in un arco di tempo molto lungo. E’ quindi indispensabile una volta diagnosticato, che il paziente oltre ad osservare rigorosamente la prescrizione terapeutica, controlli la pressione oculare per tutta la vita ed effettui periodicamente controlli del campo visivo e delle foto delle fibre nervose, dell’OCT o/e gli altri esami descritti in relazione alla valutazione dell’oculista curante. Di seguito uno schema di controllo consigliato nei pazienti in buon compenso terapeutico:
• Controllo della pressione oculare (se in buon compenso) ogni 2 mesi circa
• Visita oculistica di controllo ogni 3-4 mesi
• Effettuazione del campo visivo ogni 6-12 mesi
• Esecuzione dell’OCT delle fibre nervose ogni 6-12 mesi
• Esecuzione di altri esami strumentali in relazione al grado di evoluzione del glaucoma, all’età e su valutazione dell’oculista curanteStile di vita e nutrizione. Un paziente affetto da glaucoma può seguire una dieta regolare mangiando di tutto ma esercitare una particolare moderazione verso alcune bevande:• Caffè/tè. Dopo un’ora dal loro consumo, il caffè e il tè possono provocare un lieve aumento della IOP; l’effetto è tuttavia molto modesto e non impedisce a un paziente con un qualsiasi tipo di glaucoma di assumere queste bevande. Fondamentalmente, un glaucomatoso non deve limitare l’assunzione di liquidi; piuttosto, il consumo va distribuito durante la giornata. I pazienti che bevono molto in poco tempo (p. es., un litro in pochi minuti) andranno incontro a un aumento della IOP di breve durata. Viene quindi raccomandato di bere adeguate quantità di liquidi, ma non tutte in una volta.
• Alcol. Piccole quantità di alcol, specialmente vino, sono ben tollerate, anzi svolgono un effetto favorevole su cuore e circolazione. Un paziente glaucomatoso può concedersi un bicchiere di vino al giorno senza preoccuparsi delle conseguenze per il suo occhio.
• Fumo. Il fumo è il più importante fattore di rischio prevenibile che minacci la salute dell’uomo. Provoca il cancro e l’arteriosclerosi. Diverse malattie oculari (occlusione dei vasi retinici, maculopatia, cataratta, ecc.) sono molto più frequenti e precoci nei fumatori. I fumatori anziani presentano un rischio di sviluppare una pressione intraoculare elevata maggiore rispetto ai non fumatori, ma non vi sono evidenze che il fumo rappresenti un fattore di rischio indipendente (non correlato alla IOP) per il danno glaucomatoso.
• Marijuana. La marijuana riduce la pressione intraoculare; tuttavia, il suo impiego come farmaco non è stato studiato così a fondo da poter essere prescritta nella cura del glaucoma. I vantaggi e gli svantaggi di un trattamento prolungato con tale sostanza devono essere ancora attentamente valutati.Tempo libero e sport. Un’attività fisica regolare è importante per il paziente glaucomatoso quanto un adeguato rilassamento e un giusto numero di ore di sonno. L’attività fisica provoca una diminuzione più che un aumento della IOP; (fanno eccezione i pazienti con glaucoma da dispersione pigmentaria). La pratica di uno sport è raccomandabile anche nei pazienti con pressione arteriosa bassa, per migliorare e stabilizzare la circolazione sistemica. I pazienti che già presentino difetti del campo visivo devono essere informati del loro deficit; infatti, potrebbero non vedere la palla giocando a tennis, o un ostacolo correndo in bicicletta.
• Immersioni sottomarine. Quando si nuota o ci si immerge in acque poco profonde vi sono modeste variazioni della IOP. I glaucomatosi che intendono praticare immersioni subacquee devono consultare preventivamente il loro oculista. Quelli che presentano un’otticopatia in fase già avanzata le dovrebbe evitare.
• Sauna. La sauna può essere praticata senza preoccupazione. La IOP reagisce nei glaucomatosi allo stesso modo che nei soggetti sani: diminuisce nella sauna, ritorna al livello originario dopo un’ora. Non vi sono comunque prove che la sauna sia benefica per i glaucomatosi.
• Voli aerei. Una rapida diminuzione della pressione atmosferica può quindi provocare un (relativo) aumento della IOP. Ciò non costituisce alcun problema per un paziente glaucomatoso a bordo di un aereo: esiste infatti una pressione atmosferica artificiale all’interno della cabina degli aerei, che in gran parte compensa la naturale caduta di pressione che si registra a grandi altitudini. L’occhio si adegua in modo relativamente rapido a questa nuova situazione. Una diminuzione moderata della pressione atmosferica non aumenterà quindi la IOP in modo significativo. Un altro aspetto da considerare è la qualità dell’aria all’interno dell’aereo, che presenterà una bassa concentrazione di ossigeno ad altitudini elevate e quindi una sua minore disponibilità. Generalmente, la ventilazione all’interno del velivolo fornisce ai passeggeri un livello quasi normale di ossigeno. Ciononostante, i pazienti glaucomatosi con problemi circolatori di una certa entità che viaggiano spesso in aereo, dovrebbero consultare il proprio oculista.
• Musica. Suonare uno strumento a fiato può causare un momentaneo aumento della pressione intraoculare. I pazienti glaucomatosi che suonano tali strumenti ne dovrebbero discutere con il proprio oculista.Lenti a contatto. I portatori di lenti a contatto vanno rassicurati sul fatto che che il loro uso non ha influenza sulla IOP. In realtà, i farmaci ipotonizzanti oculari possono essere somministrati a dosaggi anche più bassi ai portatori di lenti a contatto. Ciò accade perché una parte del farmaco può essere immagazzinata nella o sotto la lente a contatto, formando un deposito con continuo rilascio della medicazione. Va comunque ricordato che alcuni farmaci rendono la superficie corneale meno sensibile. Questo aumenta la probabilità che una lesione accidentale della cornea nel posizionare la lente a contatto non sia avvertita tempestivamente. Dopo anni di uso, la congiuntiva dei portatori di lenti a contatto subisce dei cambiamenti; ne deriva che essi hanno una più elevata probabilità di occlusione della fistola qualora sottoposti ad un intervento chirurgico di questo tipo. Alcuni farmaci antiglaucoma possono aumentare i sintomi conosciuti come “occhio secco”, una condizione che rende più diffìcile l’uso delle lenti a contatto. In breve, i pazienti glaucomatosi possono usare lenti a contatto, ma solo dopo aver consultato il proprio oculista.Gravidanza, menopausa e allattamento. In media, la IOP diminuisce durante la gravidanza e subisce un moderato aumento in menopausa: queste variazioni dimostrano che gli ormoni sessuali svolgono un ruolo nella regolazione della IOP. Dal momento che il glaucoma è una malattia cronica, con una lenta progressione, si può rinviare l’inizio del trattamento a dopo il parto, ma se il danno glaucomatoso è avanzato o la IOP è molto alta, la terapia durante la gravidanza si rende necessaria ed è fattibile. L’oculista saprà quale farmaco antiglaucoma è meno dannoso per la madre e per il feto e sceglierà una terapia appropriata.